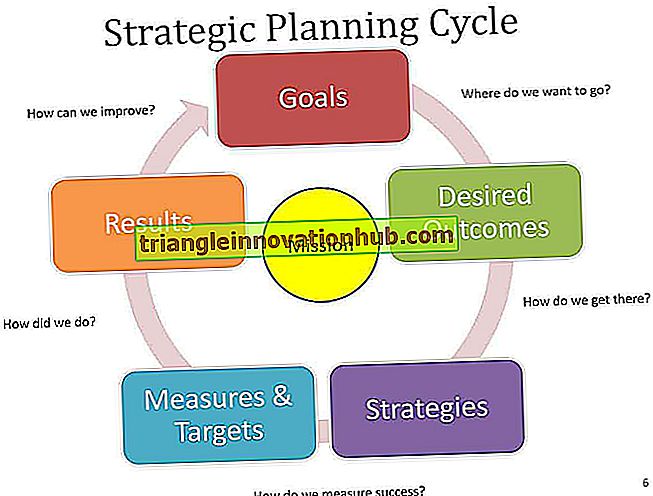
Hudsygdomme: Essay på forskellige hudsygdomme
Essay om forskellige hudsygdomme!
Hudens epidermis består af to typer af celler, keratinocytter og dendritiske celler.
De epidermis keratinocytter er arrangeret i fire lag, det basale cellelag, det pladeformede cellelag, det granulære lag og det hornede lag. Basalcellelaget består af et enkelt lag af columnar-type celler, og de indeholder keratinfilamenter eller tonofibriller.
Basalcellelagcellerne er forbundet med hinanden såvel som til de overliggende celler i pladecellelaget ved hjælp af intercellulære broer eller desmosomer. Ved deres base er basalcellelagcellerne fæstnet til den subepidermale basalmembranzone.
Den subepidermale basalmembranzone eller det dermo-epidermale kryds består af et ark ekstracellulær matrix. Elektronmikroskopi genkender tre hovedzoner i det dermo-epidermale kryds, lamina lucida, lamina densa og sublamina densa.
1. Lamina lucida-zonen (20 nm-40 nm tykkelse) ligger lige under keratinocytplasmemembranen, og den indeholder laminin, fibronectin og bullous pemphigoid antigen.
2. Lamina-densa-zonen (30 nm-60 nm tykkelse) fremstår amorf, og den indeholder type IV-kollagen. Hud inkuberet med 1 mol / L natriumchlorid (salt splittet hudtest) splitter huden gennem lamina lucida.
3. Sublamina densa-zonen indeholder elastiske mikrofibrilbundter, forankringsbundt og epidermolyse bullosa acquita antigen.
Bullous Pemphigoid:
Bullous pemphigoid (BP) er en kronisk, autoimmun, subepidermisk blærende hudsygdom. BP involverer sjældent slimhinder. BP er karakteriseret ved tilstedeværelsen af IgG-autoantistoffer, der er specifikke for de hemidesmosomale bullous pemphigoidantigener BP230 (BPAgl) og BP180 (BPAg2; type XVII-kollagen). BPAgl er en intracellulær komponent af hemidesmosomet. BPAg2 er et transmembranprotein med et collagenøst ekstracellulært domæne.
Sygdommen BP er rapporteret at forekomme hos hunde, heste og katte. Serum fra humane BP-patienter ved introduktion til nyfødte mus giver lignende hudblærer i musene. Den nøjagtige rolle af BP antigener og autoantistoffer til BP antigener i udviklingen af sygdom er ikke kendt.
IgG autoantistoffer, der binder til antigener i den basale membranzone (BMZ) af huden, fører til komplementaktivering. Komplementaktiveringen fører igen til frigivelse af inflammatoriske mediatorer og efterfølgende infiltrering af hudstedet ved inflammatoriske celler. Stofferne, såsom proteaser frigivet fra de inflammatoriske celler, menes at nedbryde hæmidermo-soaml-proteinerne og føre til blærdannelse.
Talrige eosinofiler er til stede i læsionen. Eotaxin, et kemokin, der tiltrækker eosinofil er fundet i de basale lag af epidermier af BP læsioner. Det antages, at eotaxin tiltrækker eosinofil til BMZ af BP læsioner. IL-5 er blevet påvist i huden hos BP-patienter. IL-5 har attraktive eosinofile kemo-attraktioner såvel som eosinofile aktiveringsegenskaber.
BP er en kronisk inflammatorisk sygdom. Hvis ubehandlet kan sygdommen fortsætte i måneder eller år med perioder med spontane remissioner og forværringer. Den gennemsnitlige alder af sygdomsudbrud er omkring 65 år.
jeg. Histopatologi demonstrerer en subepidermisk blister med neutrofile og eosinofile infiltrater.
ii. Direkte immunofluorescensmikroskopi (DIFM):
DIFM undersøgelse af ublæret perilesional hud fra kanten af en frisk blister demonstrerer lineært BMZ mønster af immunofluorescens hos næsten 100 procent af BP patienter. C3 alene eller IgG og C3 ses som aflejringer i BMZ. IgA og / eller IgM forekomster er også til stede hos 25 procent af patienterne, normalt i svagere intensitet og i kombination med IgG. Imidlertid ses et lineært epidermalt BMZ-mønster af immunofluorescens også i andre hudlidelser. Salt-split hud direkte hudbiopsi anvendes til differentiering.
Immunofluorescens i epidermal side (eller tag) af splitten ses i BP og svangerskabs pemphigoid. Immunofluorescens i delens dermale side (eller gulv) ses i epidermolysis bullosa acquita og bullous lupus erythematosus. Korrelation af immunofluorescensresultater med kliniske egenskaber er nødvendig for at løse problemerne.
iii. Indirekte immunfluorescensmikroskopi (IIFM): I BP-patienter afslører IIFM tilstedeværelsen af serum-IgG-antistoffer, som binder til BMZ i normal human hud. IIFM undersøgelse viser også tilstedeværelsen af cirkulerende antistoffer, der reagerer med taget af den normale menneskelige salt-splittede hud.
iv. Perifert blod eosinofili og forhøjet serum IgE er blevet fundet hos omkring halvdelen af patienterne.
v. Direkte immunoelektronmikroskopi, indirekte immunelektronmikroskopi, immunoblotting, immunfældning og ELISA-metoder kan også anvendes i diagnosen.
Patienter med aggressiv sygdom eller udbredt sygdom har brug for systemiske kortikosteroider og andre immunosuppressive lægemidler. Anvendelsen af immunosuppressive lægemidler hos ældre patienter, der kan have andre sammenfaldende lidelser (som er almindelige i alderdommen) kan føre til mange komplikationer. BP kan være dødelig, især hos svækkede patienter.
Epidermolysis Bullosa Acquisita:
Epidermolysis bullosa acquisita (EBA) er en kronisk, autoimmun, subepidermisk blæresygdom i huden og slimhinderne. EBA karakteriseres klinisk af blærer, ar og milia primært på de traumatiske områder af huden (såsom ekstensorfladerne på albuer, knæ, ankler og balder). En delmængde af patienter har imidlertid en generaliseret inflammatorisk hudblisterfænotype.
I de fleste EBA-patienter målretter IgG-autoantistofferne det ikke-kollagenholdige (NCI) domæne af type Vll-kollagen, hovedkomponenten af forankringsfibrillerne, der forbinder kælderen membranen med dermale strukturer. De autoantistoffer, der er specifikke for collagen Vll, ændrer den dermal-epidermale forbindelsesadhæsion og fører til dermal-epidermiseparation.
En lille gruppe patienter har IgG autoantistoffer til det centrale triple- (kollagen) domæne af type VII-kollagenet.
EBA er en human autoimmun hudsygdom. EBA påvirker primært huden, men det kan også involvere slimhinden. Det antages, at autoantistoffer og traumer er de medvirkende faktorer til sygdomsprocessen. EBA er en kronisk inflammatorisk sygdom med perioder med remissioner og eksacerbationer.
Passiv overførsel af IgG autoantistoffer fra humane EBA-patienter til mus inducerer ikke en klinisk sygdom i museskind.
jeg. histopatologi:
Fra kanten af den nye blister viser forekomsten af en subepidermisk blister (dvs. adskillelse har fundet sted mellem epidermis og dermis). Histologi afslører også en blandet inflammatorisk celle infiltration af dermis.
ii.DIFM:
DIFM af en normal perilesional hud opdager et tykt band af IgG i sublimina densa zonen af dermal-epidermal junction. Lineær C3-aflejring ved BMZ ses også i mindre grad. IgM eller IgA kan også ses.
iii. IIFM:
IIFM detekterer tilstedeværelsen af serumantistoffer, som binder til basalmembranzonen i det normale humane epidermal substrat. EBA-patientens serum IgG binder sig til hudbunden (nederste del) af den menneskelige normale salt-splittede hud. Dermal gulv farvning af salt splittet hud differentierer EBA fra BP (fordi i epidermal tag er farvet).
Imidlertid ses dermale gulvimmunofluorescensmønsteret for normal human salt-delt hud også med sera fra bullous SLE, anti-epiligrin cicatricial pemphigoid (med antistoffer mod laminin-5 og laminin-6) og anti-p05 pemphigoid (med autoantistoffer til et 105 kD lavere lamina lucida protein).
iv. Immunoblotting dokumenterer det specifikke hudmembranantigen (et denatureret 290 kd hudkældermembranprotein ekstraheret fra dermis, der svarer til en enkelt alfa-kæde af type VII-kollagenhomotrimermolekylet), med hvilket patientens serum IgG-autoantistof binder.
v. ELISA demonstrerer det specifikke basalmembranprotein genkendt af IgG-autoantistofferne. ELISA foretrækkes over immunoblotting, fordi ELISA-fremgangsmåden anvender nondenatureret type VII-kollagen. ELISA er mere følsom og specifik end immunoblotting.
vi. Direkte immunelektronmikroskopi dokumenterer den ultrastrukturelle lokalisering af in vivo bundet IgG autoantistoffer. Indirekte immunelektronmikroskopi detekterer cirkulerende autoantistoffer. Immunelektronmikroskopien detekterer IgG autoantistoffer ved lamina densa og sublamina densa områder af kældre membran. Men i BP er IgG-autoantistofferne lokaliseret til hemidesmosomet og øvre lamina lucida.
EBA-patienter behandles med kortikosteroider og andre immunosuppressive midler.
Herpes Gestationis:
Herpes gestationis (HS) eller pemphigoid gestationis er en sjælden autoimmun hudsygdom ved graviditet. HG er præget af ekstremt pruritic vesikler og bullae, der vises under graviditeten. Mest almindeligt udvikler læsionerne i løbet af anden og tredje trimester af graviditeten eller umiddelbart efter fødslen.
Symptomerne er tilbøjelige til at regressere spontant inden for dage efter fødslen. HG kan gentages med genoptagelse af menstruationer, brug af orale præventionsmidler og efterfølgende graviditeter. HG er blevet rapporteret at være forbundet med HLA-B8, HLA-DR3 og HLA-DR4 haplotyper.
Selvom det hedder herpes gestationis, har sygdommen ikke noget forhold til herpesvirusinfektionen; den er navngivet på grund af dens ligheder med de kliniske egenskaber ved herpetiform blærer.
Patogenesen af HG er ikke kendt. IgG autoantistoffer mod bullous pemphigoid antigen 2 (BPAg2; 180 KD) menes at binde til antigenet og udløse immunreaktionen. Immunreaktionen fører til dannelsen af sub epidermale vesikler og blærer. BPAg2 er en komponent af hæmommosom og er afgørende for dermal-epidermal adhæsion.
jeg. Histologi:
Hudbiopsi fra kanten af en blister afslører sub epidermal blister med en overvejende eosinofili infiltration.
ii. difm:
DIFM af hud fra kanten af en frisk blister afslører lineære forekomster af C3 ved epidermal BMZ. 25 procent af HG-patienter viser også lineære IgG-aflejringer. Imidlertid ses et lignende billede i BP og epidermolysis bullosa aquicita.
iii. IIFM:
Cirkulerende autoantistoffer findes kun hos 20 procent af patienterne, og titerne af antistoffer er lave. Den indirekte immunofluorescens udseende af HG med normal human hud og normal human salt splittet hud ligner den af BP (dvs. autoantistoffer binder til taget).
iv. Komplementbindingsassay for serumantistoffer:
Serien fra en HG-patient inkuberes med normal human hud efterfulgt af tilsætning af normalt humant komplement og derefter fluorescein-konjugeret antistof specifikt til komplement. Et lineært bånd af fluorescens ved det dermale-epidermale kryds indikerer tilstedeværelsen af komplementfastgørende antistoffer i serum af HG-patienten.
Imidlertid er komplementfastgørelsesantistoffer også til stede i sera fra BP og cicatricial pemphigoid patienter. Histologiske, DIFM- og IIFM-egenskaber hos HG og BP er ens. Derfor er differentiering af disse sygdomme afhængig af det kliniske billede.
HG-patienter har en højere forekomst af andre autoimmune sygdomme (såsom Hashimato thyroiditis. Graves 'sygdom og perniciøs anæmi) sammenlignet med gravide kvinder, der ikke er påvirket af HG. Orale kortikosteroider styrer sygdommen. Cytotoksiske immunosuppressive lægemidler bør undgås under graviditeten.
Dermatitis Herpetiformis:
Dermatitis herpetiformis (DH) er en immunforstået blærerhudsygdom med en associeret, oftest asymptomatisk, glutenfølsom enteropati (GSE). Hudlæsionerne er yderst kløende, grupperede vesikler, og de er mest almindeligt forekommende på ekstensorfladerne, herunder albuer, knæ, skinker, skuldre og posterior (nuchal) hovedbund.
DH forekommer hyppigere hos personer i nordeuropæiske aner og er sjældne hos asiater og afroamerikanere. DH-patienter kan have en genetisk forudsætning for at udvikle sygdommen. En stærk association af DH med HLA-haplotyper HLA-Al, HLA-B8, HLA-DR3 og HLA-DQ2 er blevet rapporteret.
Gluten er et protein til stede i byg, rug og hvede, men ikke i ris. Alle DH-patienter har en associeret GSE. Imidlertid er GSE hos DH-patienter oftest asymptomatiske. IgA-antistoffer mod gliadin (en del af hvedeprotein), reticulum og glatmuskelendomycium noteres både hos DH og GSE patienter.
Granulære IgA-aflejringer er til stede i det dermal-epidermale kryds af DH-patienter. Aflejringerne er til stede i hele huden. Imidlertid reagerer IgA-antistoffet ikke med gluten eller gliadin. IgA-aflejringerne i huden indeholder både kappa light chain og lambda light chain, hvilket indikerer at de er polyklonale. Sekretærkomponent er ikke blevet påvist i IgA af hudaflejringer. Mekanismen for IgA-aflejring i huden er ikke kendt. IgA-forekomster forsvinder længe efter undgåelse af kostgluten, hvilket tyder på, at IgA kan spille en afgørende rolle i udviklingen af DH-læsioner.
jeg. difm:
Granulære IgA-aflejringer i dermale papiller af normal fremtrædende perilesional hud observeret af DIFM er standardkriterierne for diagnose af DH. IgA-aflejringer i normal hud ses også i bullous pemphigoid, cicatricial pemphigoid, Henoch-Schonlein purpura og alkoholiske leversygdomme. Men mønsteret af IgA-aflejring i disse sygdomme er forskelligt fra IgA-aflejringen i DH.
Cirkulerende immunkomplekser indeholdende IgA er til stede hos 25-35 procent af DH-patienter. Men enhver forbindelse mellem cirkulerende immunkomplekser og sygdomsaktivitet observeres ikke. DH er også forbundet med andre autoimmune sygdomme (såsom myasthenia gravis, reumatoid arthritis, SLE) og gastrointestinale sygdomme (såsom maveatrofi, gastrisk hypochlorhydria).
Behandling med dapson lindrer symptomer inden for 24-48 timer. Hudens manifestationer kan kontrolleres med en glutenfri diæt, ofte uden medicin. Ved genoptagelse af glutendiet kommer hudlæsionerne igen. Strikkende glutenfri diæt er den eneste metode til at eliminere sygdomsformen DH-patienten.
Lineær Iga Bullous Dermatose:
Lineær IgA-bullous dermatose (LDA) er en autoimmun sub-epidermal vesiculobullous sygdom, der kan være idiopatisk eller lægemiddelinduceret. De kliniske egenskaber ved LAD kan ligne dermatitis herpetiformis eller bullous pemphigoid. Tidligere blev LAD betragtet som en variant type dermatitis herpetiformis. Børn og voksne er ramt af sygdommen. Historisk set er sygdommen hos børn omtalt som barndoms kronisk bullous dermatose.
IgA-autoantistoffer af LAD-patienter deponerer lineært ved BMZ. Antistoffaflejring fører til komplementaktivering og efterfølgende neutrofilinfiltrering i stederne for antistofaflejring. Immunreaktionen fører til tab af vedhæftning ved den dermale-epidermale forbindelses- og blærerform. Mekanismerne bag udviklingen af autoantistoffer og patogenese er ikke kendte.
Inden for det dermale-epidermale kryds er forskellige antigenmålsteder (herunder lamina lucida, sub lamina densa eller begge steder) blevet identificeret. Det bedst karakteriserede antigen er et 97 KD protein ekstraheret fra human epidermis.
Serum IgA antistoffer fra LAD patienter binder til det ekstraherede 97 KD antigen. 97 KD antigenet lokaliseres til lamina lucidaen af den saltskalede hud. Oprindeligt blev det antaget, at 97 KD proteinet kan være et unikt protein af lamina lucida. Nylige værker tyder imidlertid på, at 97 KD-proteinet kan repræsentere en del af det ekstracellulære domæne af det 180 KD bølgede pemfigoid antigen (BPAg2).
Den gennemsnitlige varighed af idiopatisk LAD i barndommen er 3, 9 år (område 2, 1 til 7, 9 år). Hos voksne er sygdommen mere langvarig, og den gennemsnitlige varighed er 5, 6 år (fra 1 til 15 år). Lægemiddelinduceret LAD opløses hurtigt, når det forårsagende lægemiddel trækkes tilbage fra patienten.
De klassiske primære læsioner af LAD er klare og / eller hæmoragiske runde eller ovale vesikler eller bullae på normal, erythematøs eller urticarial hud. Orale læsioner er almindelige hos børn, og de omfatter blærer, sårdannelser, erythematosus patches, erosioner, desquamative gingivitis eller erosiv cheilitis. Okulære symptomer såsom grinetiness, brænding eller udledning forekommer hyppigt. LAD i forbindelse med malignitet er blevet rapporteret i 5 procent af tilfældene. Mange lægemidler er impliceret i LAD (som vancomycin).
jeg. Histologi:
Hudbiopsi viser subepidermale vesikler med eosinofil eller neutrofile overvejelser, hvilket svarer til de histologiske egenskaber ved BP og DH.
ii. difm:
Direkte immunofluorescensundersøgelse af perilesion og normal hud viser IgA-aflejringer hos BMZ. Lineære aflejringer af C3 kan også ses. Lineære aflejringer af IgG, komplement og IgM ses også hos BMZ hos nogle patienter. DIF af salt splittet hud afslører IgA aflejringer på enten den dermale side (blister gulv) eller epidermal side (blister tag).
iii. IIFM:
Serum-IgA-antistoffer fra LAD-patienter binder til BMZ i apeøsofagus eller normal human hud. Med normal human salt-splittet hud viser serumantistofferne en lineær aflejring i gulvet eller taget. Kutane læsioner plejer at helbrede uden ardannelse. Slimhinneskaderne helbredes med ardannelse og udgør stor morbiditet. Ocular LAD kan ikke skelnes fra cicatricial pemphigoid og føre til blindhed.
LAD-patienter har ingen gastrointestinal sygdom eller nyder godt af en glutenfri diæt. Behandling af LAD-patienter afhænger af sygdommens sværhedsgrad og involveringsområder. Hudlæsioner reagerer på dapson. Prednison eller IFN a er også nyttige. Konjunktiv involvering kræver aggressiv terapi med prednison og cyclophosphamid for at forhindre øjenlidelse.
Pemphigus Vulgaris:
Udtrykket "pemphigus" refererer til en gruppe af autoimmune blærende sygdomme i hud- og slimhinder, der er kendetegnet histologisk ved intradermal blister og immunopatologisk ved tilstedeværelsen af in vivo bundne og cirkulerende IgG-antistoffer rettet mod celleoverfladen af keratinocytter. (Pemphigus er afledt af det græske ord petnphix, hvilket betyder boble eller blister.) Der er tre primære delmængder af pemphigus, og hver har forskellige kliniske og immunopatologiske egenskaber.
1. Pemphigus vulgaris
2. Pemphigus foliaceus
3. Paranoplastisk pemphigus
Pemphigus vulgaris (PV) er en autoimmun, intraepitelial blæresygdom af hud og slimhinder, der medieres af autoantistoffer rettet mod keratinocytcellemolekyler. Bindingen af autoantistoffer med keratinocytcelleoverflademolekyler fører til tab af celleadhæsion og efterfølgende blisterdannelse.
Mange keratinocytcelleoverflademolekyler er involveret i intercellulær adhæsion i epidermier. Autoantistoffet i pemphigus vulgaris er kendt som 'pemphigus antistoffer'. Pemphigus-antistofferne tilhører IgGl- og IgG4-underklasser. Pemphigus autoantistofferne binder til keratinocytcellemolekyler desmoglein I (160 kd) og desmoglein 3 (130 kd).
Binding af antistof med keratinocytcelleoverflademolekyler fører til komplementaktivering, hvilket igen fører til frigivelse af inflammatoriske mediatorer og infiltrering af inflammatoriske celler ind i antistofbindingsstedet. De inflammatoriske hændelser resulterer i sidste ende i blærdannelse. I de fleste patienter korrelerer sygdomsaktiviteten med serumantistoftitre. (Antistoffer der er specifikke for nondesmosomale antigener findes også i PV-patienter, men deres rolle i patogenesen af PV er ikke kendt.)
Årsagen til PV er ikke kendt. 95 procent af PV-patienter er rapporteret at være HLA-DR4 / DQw3 eller HLA-DRw6 / DQwl. Højeste alder for starten af PV er ca. 50-60 år. Imidlertid kan PV forekomme hos børn. Indiske patienter er yngre på præsentation i forhold til vestlige lande.
Næsten alle PV-patienter har mucosale læsioner. 50-70 procent PV-patienter til stede med orale læsioner. I PV opstår klapede blærer fyldt med klart væske på normal hud, men kan ses på en erythematosusbase. Blærerne er skrøbelige, og derfor kan intakte blister være sparsomme. Den berørte hud er ofte smertefuld, men pruritus er sjælden.
jeg. histopatologi:
Hud hos PV-patienter afslører en suprabasal, intraepidermal blister med tab af kohærinocytes sammenhæng (acantholyse). Histopatologi hjælper med at differentiere PV fra pemphigus foliaceus, som har en mere overfladisk epidermal spaltning.
ii. DIFM undersøgelse af hud:
DIFM udføres på normal perilesional hud. DIFM viser lineære / granulære aflejringer af IgG og C3 i epidermis intercellulære rum. Dette mønster er kendt som 'kyllingetråd'. Farvningen forekommer fortrinsvis i den nedre halvdel af epidermis. IgG-aflejringer (især IgG4) er til stede hos næsten 100 procent af patienterne, og C3 er til stede hos 50-100 procent af patienterne.
IgA- eller IgM-aflejringer ses hos 30-50 procent af PV-patienter (kun C3-aflejringer uden IgG er beskrevet i lægemiddelinduceret pemphigus og i impetigo). Hudbiopsiprøver placeret i transportmedium kan give falske negative resultater. Derfor er frisk hudvæv nødvendigt for DIFM.
iii. IIFM:
Cirkulerende IgG-autoantistoffer, der binder til epitelcelleoverflader i pladeformet epitel, er til stede i 100 procent af PV-patienter. Monkey esophagus er et egnet substrat til IIFM undersøgelse. Antistoftiteren korrelerer generelt med sygdomsaktivitet, og stigning i antistoftiter kan forudsige tilbagefald. Imidlertid kan lave titere af antistoffer med lignende immunofluorescensmønster detekteres under andre betingelser, såsom lægemiddelallergi (penicillin), SLE, myasthenia gravis, pemphigoid, lichen planus og toksisk epidermal nekrolyse.
Visse stoffer (såsom penicillamin og captopril) rapporteres at være forbundet med PV. Behandling med kortikosteroider har reduceret dødeligheden kraftigt. Alligevel forbliver signifikant morbiditet. Plasmaferese og immunsuppressive lægemidler (såsom cyclophosphamid og azathioprin) anvendes til behandling af PV.
Pemphigus Foliaceus:
Pemphigus foliaceus (PF) er generelt en godartet vifte af pemphigus vulgaris. PF er en autoimmun hudforstyrrelse præget af tab af intercellulær adhæsion af keratinocytter i de øvre dele af epidermis, hvilket resulterer i dannelsen af overfladiske blærer. PF har et kronisk kursus med ringe eller ingen inddragelse af slimhinder.
IgG (hovedsagelig IgG4-underklasse) autoantistof, der er rettet mod desmoglein I (160 kd), er et celleadhæsionsmolekyle ansvarlig for blisterdannelsen. Nedfældende faktorer af PF omfatter medicin og UV-lysstråling. De primære læsioner af PF er små overfladiske hudblærer. Disse slapte bullae er vanskelige at finde, fordi de er forbigående og omdannes til erosioner. Sygdommen PF har tendens til at fortsætte i måneder til år. PF kan forekomme i enhver alder fra barndommen og fremad. Den gennemsnitlige alder for PF er ca. 50 til 60 år.
jeg. histopatologi:
PF begynder som acantholyse af den øvre epidermis, hvilket ofte resulterer i en underhindekløft. Det forstørrer normalt og løsner uden bulla formation, selvom en bulla kan danne akantholyse på både tag og gulv. Mere etablerede læsioner kan have acanthosis og mellem-til-moderat papillomatose.
ii. difm:
De direkte immunofluorescensegenskaber af PF-hud ligner dem af PV. Men i pemphigus erythematosus (en delmængde af PF) er der lineær IgG farvning af epidermal intercellulært rum kombineret med granulære aflejringer langs BMZ.
iii. IIFM:
IIFM detekterer intercellulær farvning IgG i serum på ca. 90 procent af PF-patienter, når aberøsøs esophagus anvendes som substrat. Marsvin-spiserør synes at være et bedre substrat, fordi det er mere følsomt og detekterer antistoffer i de resterende 10 procent af PF-patienter.
Sammenlignet med PV er mindre aggressiv terapi tilstrækkelig til at behandle PF på grund af dets lavere morbiditet og dødelighed. Aktuelle kortikosteroider er effektive. I mere ekstreme tilfælde kan adjuvans immunosuppressiv være nødvendig. Hos patienter med recalcitrant sygdom er plasmaferese nyttig.
Paraneoplastisk Pemphigus:
Paranoplastisk pemphigus (PNP) er et autoimmunt syndrom, der har træk, der minder om både pemphigus vulgaris og erythema multiforme. PNP-patienter har en underliggende malignitet, som regel en lymforetisk malignitet.
Følgende kriterier er nødvendige for diagnosticering af PNP:
jeg. Smertefulde slimhinde læsioner, nogle gange med en hududbrud, der i sidste ende resulterer i blærer og erosioner i forbindelse med bekræftelse eller okkult malignitet.
ii. Histopatologiske ændringer af acantholyse, keratinocytnekrose og interface dermatitis.
iii. DIFM-observation af immunoreaktive midler, typisk IgG og C3 inden for de epidermale intercellulære rum såvel som epidermal basalmembranen.
iv. IIFM obsevation af serumantistoffer, der er specifikke for stratificerede kvælte eller overgangsepiteler.
v. Immunpræcipitation af et kompleks af proteiner med typiske molekylvægte.
Patogenesen af PNP er ikke kendt. Humoral og cellulær immunrespons induceret mod tumorantigener kan reagere med plakiner. Reaktionen af autoantistoffer med plakiner kan føre til blæren af slimhinder og andre epithelier.
NonHodgkin lymfom er den mest almindelige malignitet forbundet med PNP. Andre maligniteter, der er forbundet med PNP, er kronisk lymfocytisk leukæmi, Castleman-tumor, gigantisk lymfom, Waldenstroms macroglobulinæmi, thymom, dårligt differentieret sarkom, bronkogent pladecellecarcinom og follikulær dendritisk celle sarkom.
På tidspunktet for indledningen af PNP er patienterne måske ikke blevet diagnosticeret for at have en ondartet sygdom. Hvis PNP mistænkes hos en patient, er en grundig søgning efter en underliggende malignitet berettiget.
Prognosen for PNP er relateret til den associerede, malignitet og dens behandling. Fjernelse af tumor kan tilbyde remission af hudlæsioner. Desværre er de fleste tumorer maligne, og det er ikke muligt at fjerne tumor i alle patienter. Aggressiv behandling med systemiske kortikosteroider, cyclophosphamid, azathioprin, plasmaferes og IVIg er blevet anvendt. Men succesen er begrænset. Selv aggressiv terapi kan føre til mange komplikationer. Immunoablativ højdosis cyclophosphamid uden stamcelle redning for lymfomassocieret PNP har en lovende fremtid.
jeg. difm:
DIFM af perilesionhud og / eller slimhinde viser IgG, med eller uden komplementaflejringer i det intercellulære rum af epidermier. IgM- og IgA-aflejringer kan også findes, og immunfluorescensfarvningen kan være diffus eller fokal. Nogle patienter har granulære eller lineære forekomster af komplement og IgG og / eller IgM langs det dermale-epidermale kryds. Kombinationen af intercellulær og subepideramal deponering af immunoreaktive midler er et tegn på diagnosen af PNP.
ii. IIFM:
Antistofferne i sera fra PNP-patienter binder til celleoverfladen af stratificeret kvælstofepitel. Sera fra alle former for pemphigus binder imidlertid også til celleoverfladen af stratificeret pladepitel. Derfor anvendes gnaverblære som immunfluorescenssubstratet til at skelne PNP fra PV og PF. Sera fra PNP-patienter binder til gnaverblæreovergangspitel.
iii. Immunpræcipitationsanalyse:
Immunudfældning er standard diagnostisk test for PNP, fordi testen har en højere specificitet og følsomhed end IIFM. Antistoffer i sera af PNP-patienter reagerer med et antal plakinfamiliemolekyler, herunder desmoplakin I (250 kd), BPAg I (230 kd), desmoplakin II (210 kd), envoplakin (210 kd), periplakin (190 kd), HDl / plectin (500 kd) og et uidentificeret 170 kd protein. Autoantistoffer fra nogle patienter binder også til desmoglein I og desmoglein II antigener.
Systemisk lupus erythematosus:
Direkte immunfluorescensundersøgelser viser kurs, granulær, kontinuert, forekomster af immunoglobuliner og komplement langs epidermal BMZ hos 50 til 95 procent af patienter med systemisk lupus erythematosus (SLE). BMZ-aflejringer af komplementmembranangrebskomplekser (C5b6789) set i læsionshuden kan være en markør for SLE. Almindeligvis ses IgG-, IgM- og komplementkomponenter (C3- og / eller Clq) -aflejringer. Alle klasser af immunglobuliner kan identificeres i SLE.
Imidlertid kan lignende mønstre ses i andre lidelser, såsom blandede bindevævssygdomme, dermatomyositis, GVH-sygdom, lægemiddeludbrud og vaskulitis. Derfor bør resultaterne af immunfluorescensstudien korreleres med kliniske træk og histopatologi af huden.
vaskulitis:
Biopsi af en vaskulitis læsion inden for 24 timer efter starten kan vise vaskulære aflejringer af IgM, C3, fibrinogen og undertiden IgG. Et negativt resultat udelukker imidlertid ikke vaskulitis. Biopsi af en læsion ældre end 24 timer kan ikke være til hjælp. Henoch-Schonlein purpura diagnosticeres, når granulær IgA, med eller uden C3, vaskulær immunforsvar ses i passende klinisk indstilling.